«Advanced Materials»是材料与化学领域的顶尖期刊。在国际材料领域科研界上享誉盛名,该期刊接收与材料领域相关的顶尖科研成果,其接收率只有10%-15%,目前,它的影响因子为30.849。
近年来,周绍兵教授团队一直致力于高分子纳米药物载体材料的研究,取得了多项重要成果,开发出新型靶向纳米载体和环境响应纳米载体,对恶性肿瘤等重大疾病在动物实验研究上表现出优异的治疗效果。团队已在Advanced Materials, Science Advances, Progress in Polymer Science等高影响期刊发表了100余篇论文,获得了20余项国家发明专利,研究成果正与多家企业合作,期望能将相关成果进行临床转化。
程序性死亡受体1(PD-1)及其主要配体PD-L1的检查点抑制剂治疗在某些癌症中取得了令人鼓舞的临床疗效。然而,由于检查点抑制剂与其他表达PD-L1的免疫细胞(如抗原提呈细胞、活化的B细胞和巨噬细胞等)结合而引起的免疫功能的干扰,往往导致对阻断的应答率低(-20%)和严重的不良反应。因此,使检查点抑制剂能够选择性的在肿瘤组织富集对提高免疫治疗疗效是至关重要的。
近日,西南交通大学周绍兵教授团队博士研究生潘敬梅历经3年时间制备了一种负载PD-1质粒的LyP1多肽修饰的细菌外膜囊泡,以实现对肿瘤细胞PD-L1的自我阻断。纳米载体通过细菌外膜囊泡的靶向能力在肿瘤组织中聚集,并通过LyP1介导的靶向内化到肿瘤细胞内,随后将PD-1质粒送入细胞核,使肿瘤细胞表达PD-1(图1)。另外我们开发了一种用于定量检测PD-1/PD-L1结合量的磁微粒化学发光试剂盒,自身表达的PD-1与自体和邻近肿瘤细胞表达的PD-L1结合,实现了自我阻断。因此,它可以重新激活细胞毒性淋巴细胞(CTL),以根除癌细胞。同时,该纳米载体成分的外膜蛋白可将CTL和自然杀伤细胞(NK)募集到肿瘤组织中,刺激其分泌干扰素-γ,进一步提高PD-1/PD-L1自身封闭治疗的抗肿瘤活性。该策略对4T1,CT26,B16这三种肿瘤模型均表现出优异的抑瘤效果,并且纳米载体对4T1和B16肿瘤的阻断率分别为94.7%和96.7%,分别是PD-L1单克隆抗体的1.90倍和9.04倍。因此,这种简单安全的策略为肿瘤免疫治疗纳米药物的开发铺平了道路。
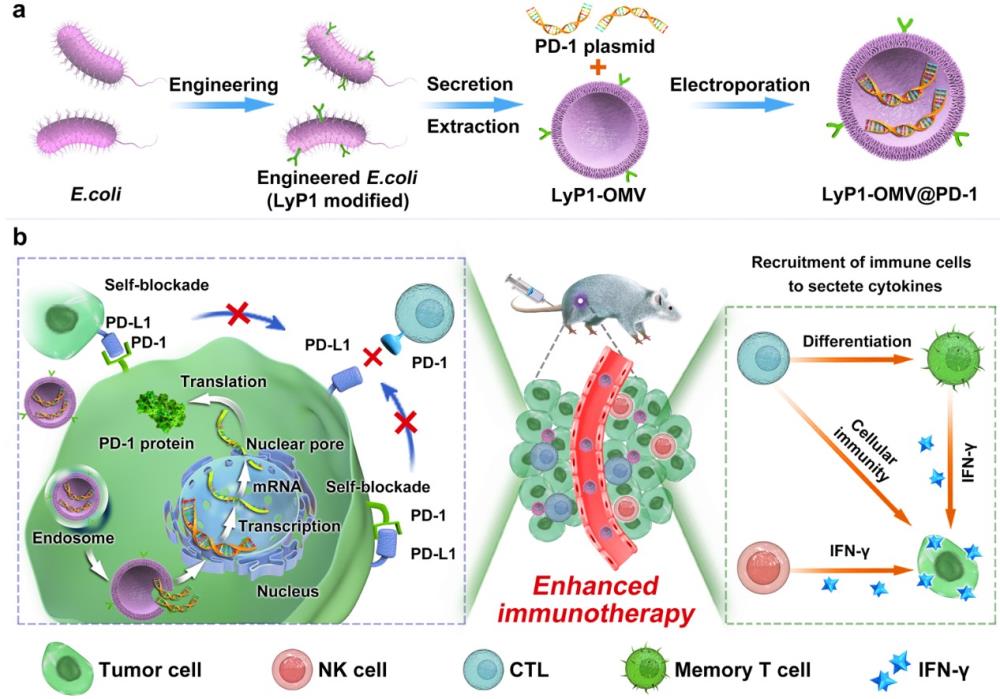
图1 肿瘤细胞PD-L1自阻断的示意图
以上相关成果发表于Advanced Materials (2021, 2106307)上。论文的第一作者为西南交通大学材料科学与工程学院博士研究生潘敬梅,通讯作者为郭星教授和周绍兵教授。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202106307