近日,西南交通大学材料工程与科学学院周绍兵教授团队在用高分子纳米药物抗肿瘤以及抑制肿瘤转移方面取得最新研究进展。相关研究成果以“Development of a pH-responsive polymersome inducing endoplasmic reticulum stress andautophagy blockade”为题,发表在综合性顶级期刊《Science Advances》上,我校为唯一作者单位,徐傅能博士为论文第一作者,周绍兵教授为论文通讯作者。这也是我校以第一单位首次在该期刊发表研究论文。
纳米药物在肿瘤治疗中因其可以解决药物水溶性差、副作用大的问题而成为抗肿瘤研究的热点,通常纳米药物携带的化疗药物都是以细胞核DNA为靶点进行抗肿瘤治疗,而仅存在于细胞核DNA的核苷酸切除修复机制可修复化疗药物产生的DNA损害,削弱其抗肿瘤效果。同时,与多细胞器关系密切的必要且保守的生理分解代谢过程-自噬,与细胞的命运以及肿瘤的发生、发展都紧密相关。因此,以非细胞核DNA为靶点的,调控细胞中重要细胞器达到自噬调控目的的抗肿瘤研究不失为一种新的策略。
鉴于此,周绍兵团队设计制备了一种pH响应的聚合物囊泡,可同时向肿瘤细胞递送衣霉素(Tuni)和羟基氯喹(HCQ),实现内质网应激和自噬流阻断,提高抗肿瘤效果和抑制肿瘤转移。聚合物囊泡通过内吞进入细胞,聚(β-氨基酯)作为囊泡疏水链段,因其重复的叔胺基团在溶酶体酸性环境中迅速质子化而变得亲水,这一pH响应过程一方面碱化破坏溶酶体,协同HCQ的溶酶体脱酸化作用,共同达到对大范围内溶酶体的破坏;另一方面,导致了囊泡结构的崩解,达到刺激响应快速释药的目的。释放出的Tuni导致内质网应激的发生,调控PERK/Akt/mTOR信号通路,提高细胞内以自噬体、自噬溶酶体以及自噬相关蛋白LC-Ⅱ为特征的自噬水平的提高。而溶酶体被破坏使自噬流无法最终完成,产生的特殊的“自噬性压力”,而取得良好的抗肿瘤效果(图1)。
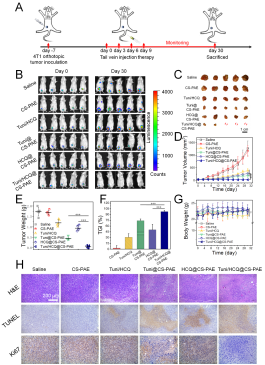
图1 聚合物囊泡的抗肿瘤评价
同时,存在于细胞膜上的跨膜蛋白集合-黏着斑的更替速率限制了肿瘤的转移速率,自噬流被阻断极大限制了黏着斑的更替;内质网应激相关信号通路的改变也导致了肿瘤转移的重要帮手-基质金属蛋白酶-2的分泌减少,在两者的共同作用下,小鼠乳腺癌的典型转移部位-肺部的转移被有效抑制(图2)。
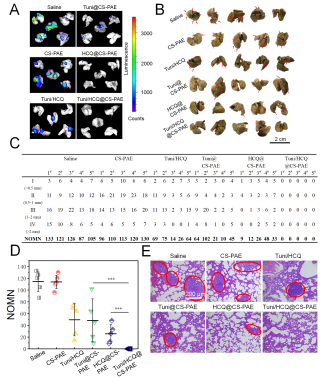
图2 聚合物囊泡的肿瘤转移抑制评价
原文链接:https://advances.sciencemag.org/content/6/31/eabb8725